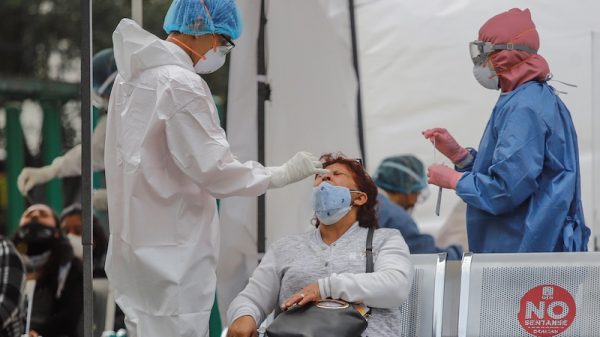
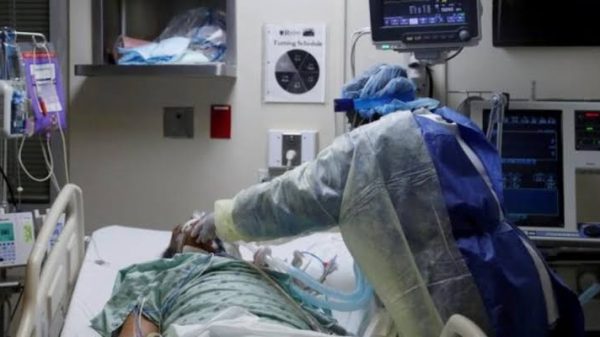
Pfizer y su socio BioNTech solicitaron la autorización reglamentaria para su vacuna contra el covid-19 en la Unión Europea, lo que encaminó la posibilidad de una aprobación allí antes de que finalice este año.
De acuerdo con BLOOMBERG, la Agencia Europea de Medicamentos (AEM) informó este martes que podría emitir una opinión en unas semanas, con una reunión sobre la evaluación programada, a más tardar, para el 29 de diciembre.
La solicitud formal cierra un proceso de revisión continuo que comenzó el 6 de octubre y permitió al regulador europeo de medicamentos examinar los datos sobre la vacuna a medida que surgía.
Los gobiernos de todo el mundo están ansiosos por comenzar a inmunizar a sus poblaciones para frenar la pandemia. Moderna también solicitó la autorización de emergencia en Estados Unidos y Europa el lunes.
Por otra parte, Reino Unido invocó una regla especial para permitir que su regulador no necesite el permiso de su homólogo de la UE y puede ser el primer país en aprobar el producto Pfizer-BioNTech. Estados Unidos no se está quedando atrás, pues un panel de la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) se reunirá el 10 de diciembre para discutir la vacuna.
BioNTech puede comenzar a enviar las primeras dosis “en cuestión de horas” después de la aprobación regulatoria, afirmó el director financiero Sierk Poetting en una conferencia de prensa.
En noviembre, un estudio de casi 44 mil personas mostró que la vacuna previno 95 por ciento de los casos sintomáticos de Covid-19.
Si la AEM concluye que los beneficios de la inyección de Pfizer-BioNTech superan sus riesgos, recomendará otorgar una autorización condicional que podría permitir la implementación de la dosis en Europa antes de fin de año, dijeron las compañías en un comunicado.
Pfizer y BioNTech también iniciaron el trámite de aplicaciones regulatorias en otros países, incluidos Australia, Canadá y Japón. Los socios han firmado acuerdos para entregar cientos de millones de dosis de la vacuna, incluido un acuerdo con la UE por 200 millones de dosis, con la opción de 100 millones adicionales.
Una autorización condicional se emite cuando las autoridades europeas desean entregar un medicamento a los pacientes rápidamente sin esperar un paquete de datos tan completo como normalmente se requeriría para una autorización estándar. Tiene una validez de un año y puede renovarse y, finalmente, convertirse en una aprobación estándar.
Comentarios
0 comentarios