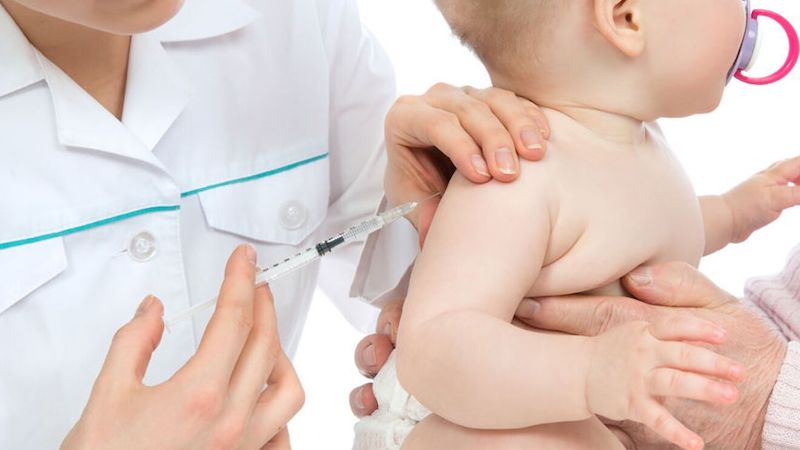
El consorcio de compañías integrado por Pfizer y BioNtech presentarán este martes a la Administración de Alimentos y Medicamentos de EU (FDA) una solicitud de autorización de uso de emergencia para su nueva versión de la vacuna contra el COVID-19 para menores de seis meses a cinco años de edad, misma que podría estar disponible a finales de este mismo mes de febrero.
El fármaco podrá ser administrado a menores de entre 6 meses y 5 años, lo que la convertiría en la primera que sale al mercado para ese grupo de edad.
La FDA instó a las empresas a presentar la solicitud para que los reguladores pudieran comenzar a revisar los datos obtenidos por las compañías tras administrar dos dosis de la vacuna.
En los últimos meses, el consorcio farmacéutico ha estado probando además una tercera dosis entre este colectivo, después de que los resultados obtenidos en cuanto a inmunización al aplicar dos inyecciones no fueron del todo satisfactorios.
La compañía ha constatado que las dos dosis de la vacuna en menores es segura y analizan ahora los resultados con una inyección de refuerzo, aunque no estarán disponibles hasta, al menos, finales de marzo.
Una vez que se envíe esa información a la FDA se espera que los reguladores autoricen también una tercera dosis de la vacuna pediátrica
Comentarios
0 comentarios